Тема
Обчислення за хімічною формулою молярної маси, маси і кількості речовини.
Мета уроку
навчитись обчислювати за хімічною формулою показники молярної маси, маси і кількості речовини.
Задачі уроку
1. Згадати визначення понять : «кількість речовини», «маса речовини», «молярна маса речовини»; називати хімічні формули їх знаходження.
2. Навчитись користуватися вивченими величинами при вирішенні задач.
Хід уроку
Повторення
Кількість речовини - число молекул, атомів, іонів і інших специфічних структурних елементів, з яких складається речовина. У СІ одиницею кількості речовини встановлений моль.
Маса і кількість речовини — поняття різні. Маса виражається в кілограмах (грамах), а кількість речовини — в молях. Між масою речовини (т, г), кількістю речовини (п, міль) і молярною масою (М-код, г/моль) існують прості співвідношення: m=nМ, n=m/М, M=m/n. По цих формулах легко обчислити масу певної кількості речовини, або визначити кількість речовини у відомій масі його, або знайти молярну масу речовини.

Малюнок 1. Маса Землі = 5.9742 × 1024 килограмма.
Закон збереження маси речовини
Маса речовин, вступаючих в хімічну реакцію, дорівнює масі речовин, що утворюються в результаті реакції.
Закон збереження маси є окремим випадком загального закону природи – закону збереження матерії і енергії. На підставі цього закону хімічні реакції можна відображувати за допомогою хімічних рівнянь, використовуючи хімічні формули речовин і стехіометричні коефіцієнти, що відображають відносні кількості (число молей) речовин, що беруть участь в реакції.
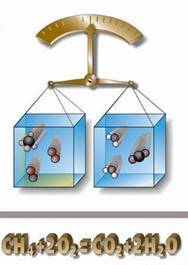
Малюнок 2. Закон збереження маси речовини.
Пропоную переглянути вам це відео. На ньому ви побачите експериментальне підтвердження Закону збереження маси речовини.
Відео 1. Закон збереження маси речовини.
Молярна маса речовини (M) – маса одного моля цієї речовини. По величині вона дорівнює відносній молекулярній масі Mr (для речовин атомної будови – відносній атомній масі Ar). Молярна маса має розмірність г/міль. Наприклад, молярна маса метану CH4 визначається таким чином:
Мr(Ch4)= Ar(C)+ 4 Ar(H)= 12+4 =16
M(Ch4)=16 г/міль,тобто 16 г Ch4 містять 6,02Ч1023 молекули.
Молярну масу речовини можна обчислити, якщо відомі його маса m і кількість (число молей) n, по формулі:
M=m/v.
Відповідно, знаючи масу і молярну масу речовини, можна розрахувати число його молей :
v=m/M. або знайти масу речовини по числу молей і молярній масі: m = n Ч M .
На цьому малюнку ми бачимо кисень. Його молярна маса 15,9994 (г/моль). Це найпоширеніша речовина на Землі.

Малюнок 3. Кисень(O2).
На цьому відео давайте проглянемо для чого нам потрібен кисень і в яких сферах життєдіяльності його використовують. Відео 2. Використання кисеню.
Контролюючий блок № 1
1. Охарактеризуйте поняття : «молярна маса», «кількість речовини», «маса речовини», назвіть хімічні формули їх знаходження. Поясніть, як ви розумієте Закон збереження маси речовини?
Розвязування задач
Необхідно відзначити, що значення молярної маси речовини визначається його якісним і кількісним складом, тобто залежить від Mr і Ar. Тому різні речовини при однаковій кількості молей мають різні маси m.
Задача 1.
Обчислити маси метану CH4 і етану С2H6, узятих в кількості n = 2 міль кожного.
Рішення:
Молярна маса метану дорівнює 16 г/моль, а етану С2Н6 – 30 г/моль.
Звідси: m(CH4)= 2 моль ,Ч 16 г/моль = 32 г; m(С2Н6)= 2 моль, Ч 30 г/моль = 60 г.
Пропоную переглянути відео-урок учнів. Воно допоможе вам при вирішенні задач.
Відео 3. Знаходження маси речовини, її кількості, об’єму та молярної маси.
Скільки молей складають і скільки молекул містять 8 г кисню 02?
Дано: m(02)=8г; Знайти n(02);N(02)
Рішення:
Mr(02)=16•2=32
M(02)=16•2=32г/моль
n(02)=m(02)/m(02)=8г/32г/моль =0,25 моль
N(02)=NA•n(02)=6,02•1023моль-1•0,25 моль =1,505•1023
Відповідь: 8 г кисню складають 0,25 моль і містять 1,505•1023 молекули
Задача 3.
Скільки молей складають і скільки молекул містять 180 мл води H2О ?
Дано: V(H2О)= 180мл=180см3; Знайти: n(H2О); N(H2О)
Рішення:
Щільність води ρ(H2О)=1г/см3
m(H2О)=V(H2О)•ρ(H2О)=180см3•1г/см3=180г
Знаходимо молярну масу води М(H2О)=2+16=18 г/моль
Знаходимо кількість речовини n(H2О)=m(H2О)/М(H2О)=180г/18г/моль=10 моль Число молекул дорівнює N(H2О)=NA•n(H2О)=6,02•1023моль-1•10 моль=6,02•1024
Відповідь: 180 мл води складають 10 моль і містять 6,02•1024 молекули.
Контролюючий блок № 2
Вирішити задачі:
1.Визначити масу молекули аміаку (NH3) mo =2,7*10-26кг
2.Скільки молекул міститься в кисні масою 0,16 кг? N = 3*1024
3. Який об'єм займають 100 моль ртуті? V = 1,5*10-3м3 = 1,5 л
4. Знайти число атомів в алюмінієвому предметі масою 135 р. N = 3*1024
5. Підрахувати число молекул, що містяться 1 кг вуглекислого газу; знайти масу однієї молекули. N = 1,37*1025 mо =7,3*10-26кг
Цікаво знати, що …
Кисень важчий за повітря. Якщо зрівноважити на вагах порожній стакан, а потім через трубку наповнити його киснем, то рівновага порушиться.
Кисень може бути не лише газоподібним, але і рідким і навіть твердим. Рідкий кисень – рухлива, злегка голубувата рідина, кипляча при температурі -183 градуса Цельсії. А твердий кисень виглядає як кристали синього кольору, плавкі при ще нижчій температурі, – 218,7 градуса Цельсії.
Всі рослини планети Земля протягом року створюють близько 300 мільярдів тонн кисню.
До браку кисню приводять пригнічені емоції, - вважають учені. Внутрішня заборона на вираження сильних емоції приводить до того, що людина «затискається», а його дихання стає переривистим і поверхневим. Людина, як біологічний вид сформувалася, коли концентрація кисню в атмосфері Землі досягла 38 – 40%.
За добу здорова людина в спокійному стані прокачує через легені 7200 л повітря, безповоротно забираючи з атмосфери 720 л кисню. Вміст кисню в сучасній атмосфері – 21%.
У крупних містах кількість кисню в повітрі може знижуватися до 17 – 18 %, а за несприятливих метеорологічних умов до 12 – 15%. Недолік кисню чоловік починає відчувати вже при його зниженні в атмосфері до 18%. А критичними для життя є 7%.